




Proteine sind wichtige makromolekulare Bausteine der Natur, die - aus vergleichsweise wenigen unterschiedlichen Aminosäuren aufgebaut - höchste Vielfalt und Komplexität erreichen. Proteine erfüllen in der Zelle viele verschiedene Funktionen, seien es die Zytochrome, die dem Elektronentransport dienen, oder aber Kanalproteine, die abhängig von bestimmten Umgebungsfaktoren wie pH-Wert oder Temperatur ganz spezifische Ionen - und nur diese! - durch die andernfalls undurchlässige Zellwand transportieren.
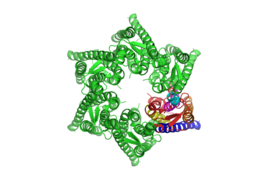
Das humane Connexin 26 (hCx26) beispielsweise, bildet einen Zell-Zell-Kanal zum Transport von Ca2+-Ionen von Zelle zu Zelle. Jede Zelle bildet einen Halbkanal (siehe Abb. 1 in Aufsicht und Abb. 2 in Seitenansicht), so dass, wenn die beiden Halbkanäle aneinander andocken und geöffnet sind, Ca2+-Ionen von einer Zelle in die andere durchgereicht werden können.
Beim Öffnen des Kanals verändert das Protein als Makromolekül seine Konformation, so dass die zentrale Pore erweitert wird und kleine Atome passieren können. Oftmals werden im Protein verbaute Aminosäuren mit geladenen Molekülgruppen durch die Konformationsänderung verdeckt oder exponiert, so dass gezielt Ionen angezogen werden. Diese Konformationsänderungen experimentell nachzuweisen ist eine der großen Herausforderungen in der Proteinforschung. Proteinstrukturen werden für gewöhnlich mit Rasterkraftmikroskopie, Röntgen-Kristallografie und Elektronenmikroskopie untersucht, die dabei erforderlichen Präparationen sind aber mit vielen durch spezifische Umweltparameter bedingte Konformationen nicht kompatibel.
Mit Hilfe hochauflösender konfokaler Ramanspektroskopie ist am HOT gelungen, gerade solche Proteinkonformationen in situ zu untersuchen. Da auf eine Fixierung oder gar Kristallisierung der Proteine verzichtet werden kann, ist es möglich, die Ramanspektren des Proteins in beiden Konformationen aufzunehmen und direkt zu vergleichen. So konnte bspw. für das oben erwähnte humane Connexin 26 die Annahme bestätigt werden, dass das vollständige Schließen des Halbkanals bei einem Temperaturabfall unter 23°C durch eine Drehung der extrazellulären Schleife an der ersten Transmembranhelix mit einer Beteiligung der vierten Transmembranhelix geschieht. Insbesondere konnte auch ein direkter Indikator für einen geschlossenen Halbkanal im Ramanspektrum selbst gefunden werden.
Siehe auch
A.-K. Kniggendorf, M. Meinhardt-Wollweber, X. Yuan, B. Roth, A. Seifert, N. Fertig, and C. Zeilinger: Temperature-sensitive gating of hCx26: high-resolution Raman spectroscopy sheds light on conformational changes
2014. Biomedical Optics Express 5 (7) doi: 10.1364/BOE.5.002054
