Das maligne Melanom der Haut (schwarzer Hautkrebs) ist der gefährlichste Hautkrebstyp und eine der gefährlichsten Krebsarten überhaupt, da es bereits in einem beschwerdefreien Stadium und bei kleiner Tumorgröße metastasieren kann. Für Patienten im Stadium der Fernmetastasierung, d.h. bei Tochtertumoren in anderen Organen, liegen die 5-Jahres-Überlebensraten unter zehn Prozent und bisherige Therapieansätze können keine echte Heilung erzielen. In frühen Tumorstadien sind die Heilungschancen nach vollständiger Entfernung (Exzision) des Melanoms hingegen sehr gut. Das im Zuge der klinischen Diagnostik vermutete Stadium eines malignen Melanoms entscheidet darüber, wie viel gesundes Gewebe sicherheitshalber bei der Operation mit entfernt wird. Die Diagnose eines Melanoms kann erst mit Hilfe von entnommenem Gewebe stattfinden. Die Tumordicke bzw. Invasionstiefe ist ein maßgebliches Kriterium für das Tumorstadium und entscheidend für die weitere Behandlung und Prognose. Im Allgemeinen sind daher primäre Entwicklungsziele der Melanomdiagnose und –behandlung die Verbesserung der Tumorerkennung inklusive einer zuverlässigen präoperativen Tumordickenabschätzung und die Vermeidung unnötiger Operationen.
Im Rahmen dieses Vorhabens wird ein Verfahren zur präoperativen Bestimmung der Dicke von Melanom-verdächtigen Hautläsionen entwickelt und validiert werden, siehe Abb. 1 zur aktuellen Version. Da sonographische Methoden bisher keine zufriedenstellende Lösung bieten, ist dafür eine Kombination verschiedener optischer Verfahren notwendig. Das zu entwickelnde bildgebende System soll es Medizinern in Zukunft erstmalig ermöglichen, präoperativ die Tumordicke mit einer hohen Genauigkeit zuverlässig zu bestimmen, um die Entfernung gesunden Gewebes zu minimieren. Darüber hinaus soll das System spektroskopische und morphologische Informationen liefern, die präoperativ eine genauere Bestimmung des Tumorstadiums zulassen, insbesondere ob der Tumor auf die oberste Hautschicht, die Epidermis, begrenzt ist. Die zuverlässige und genaue Dickenbestimmung von Tumoren bis zu mehreren Millimetern Dicke ist derzeit präoperativ nicht möglich und würde gemeinsam mit den zusätzlichen diagnostischen Informationen eine signifikante Verbesserung darstellen. Das neue System deckt diesen Bedarf und ermöglicht in vivo Messungen unterhalb maximal zulässiger Bestrahlungsstärken, siehe Abb. 2 und 3. Zur Erhöhung der Sensitivität und Spezifität wird eine Datenbank aus den klinischen Messungen aufgebaut und Algorithmen der künstlichen Intelligenz (KI) eingesetzt, um die Klassifizierung der Hautläsionen zu verbessern.



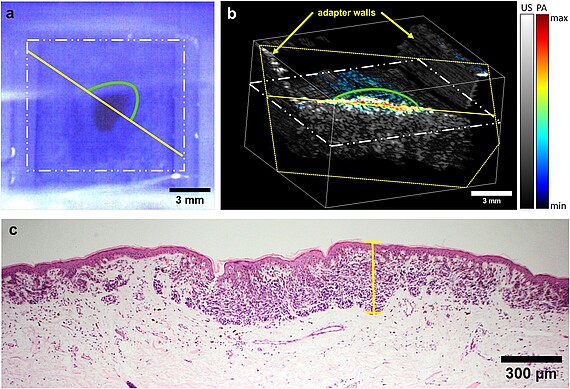
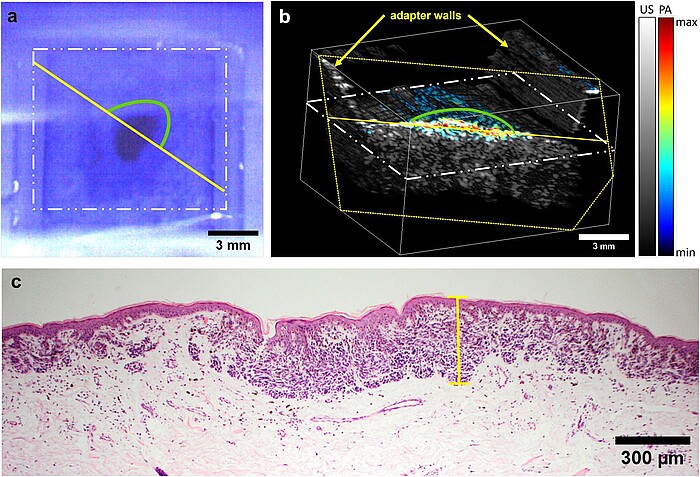
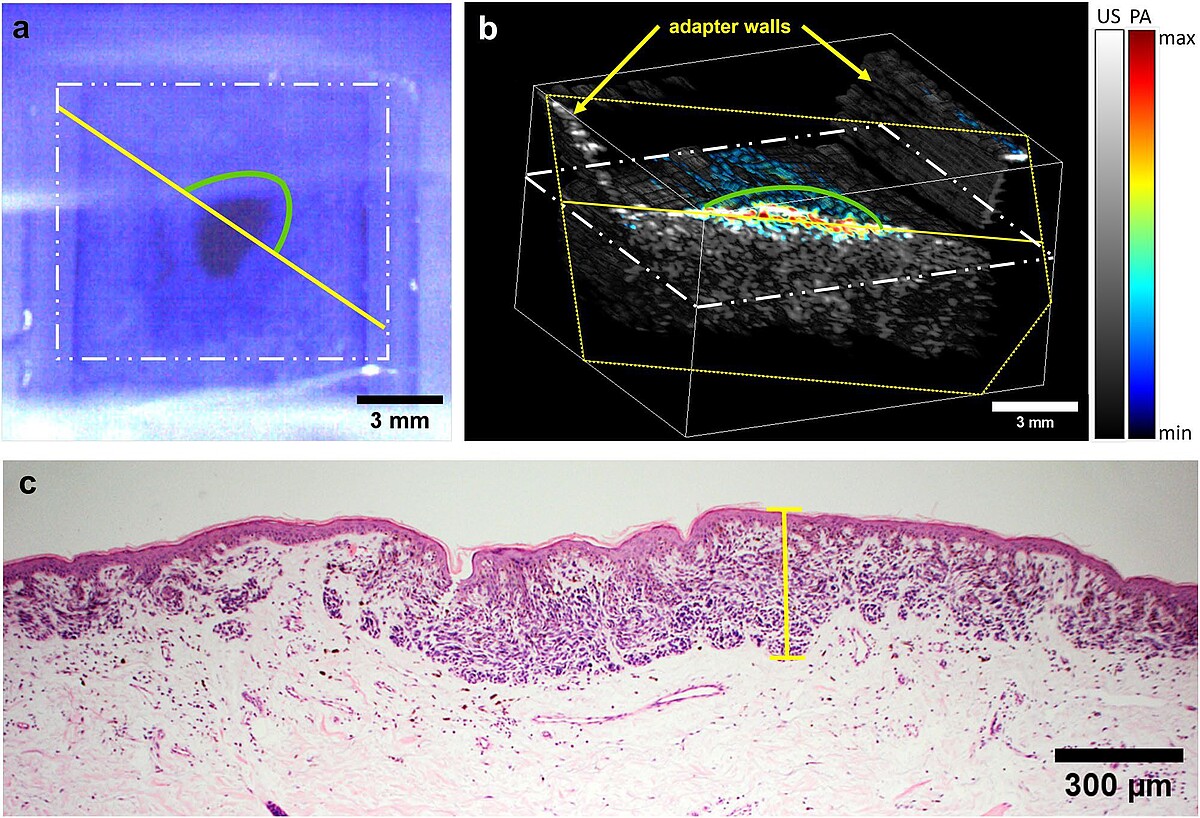
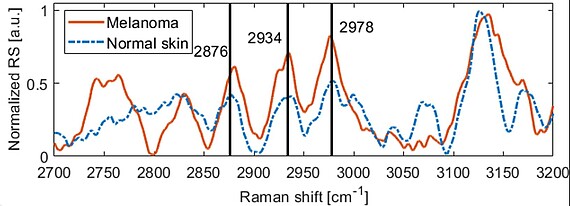
Das in einem Messkopf integrierte System bietet Potenzial zur weiteren Miniaturisierung und Einsparung von Ressourcen. Ausserdem erlaubt es es eine intuitive Bedienung, kurze Messzeiten und die Möglichkeit, Algorithmen der erklärbaren KI anzuwenden, um Patientinnen und Patienten an dem Prozess partizipieren zu lassen und besser hinsichtlich Selbstüberwachung von Hautveränderungen zu schulen.
Referenzen
- Non-invasive 3D imaging of human melanocytic lesions by combined ultrasound and photoacoustic tomography: a pilot study, AF Kukk, F Scheling, R Panzer, S Emmert, B Roth, Scientific Reports 14 (1), 2768 (2024)
- Non-invasive optical biopsy of skin lesions by multimodal system with OCT, ultrasound, photoacoustics and Raman spectroscopy, AF Kukk, D Wu, R Panzer, S Emmert, B Roth, Proc. Photonics West 2024 (San Francisco, USA), Multimodal Biomedical Imaging XIX 12834, 56-61 (2024)
- Combined ultrasound and photoacoustic C-mode imaging system for skin lesion assessment, AF Kukk, F Scheling, R Panzer, S Emmert, B Roth, Scientific Reports 13 (1), 17947 (2023)
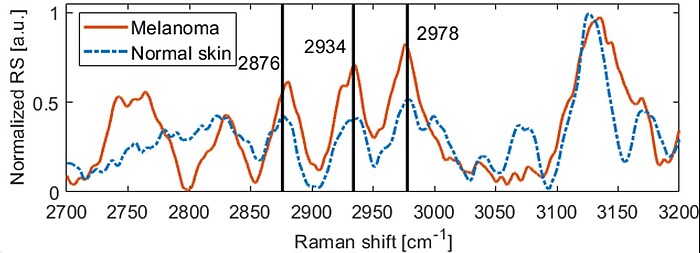
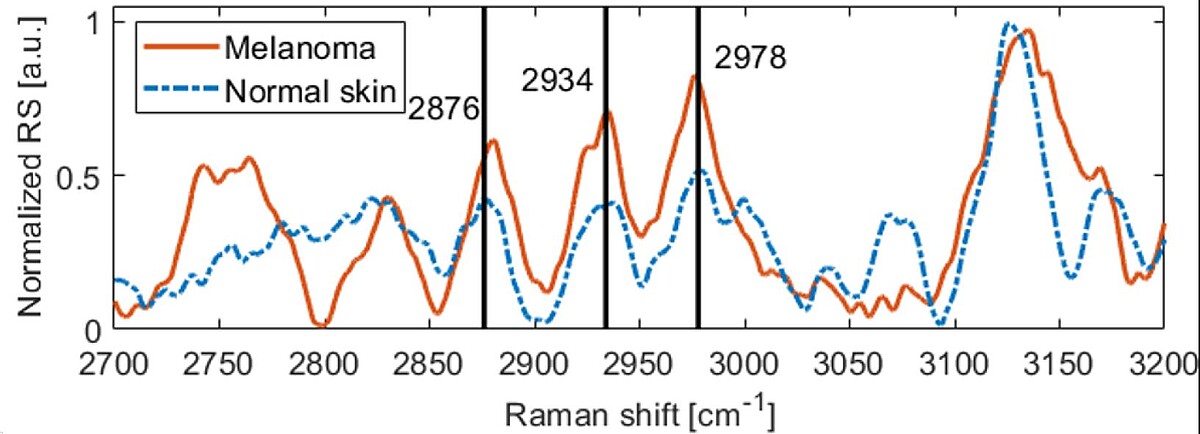
- Detection of melanin influence on skin samples based on Raman spectroscopy and optical coherence tomography dual‐modal approach, D Wu, AF Kukk, B Roth, Journal of Biophotonics 16 (8), e202300080 (2023)
- Multimodal system for optical biopsy of melanoma with integrated ultrasound, optical coherence tomography and Raman spectroscopy, A Fedorov Kukk, D Wu, E Gaffal, R Panzer, S Emmert, B Roth, Journal of Biophotonics 15 (10), e202200129 (2022)
Forschungsprojekte
-
Multimodales System für die optische Biopsie von schwarzem HautkrebsIm Fokus steht die Entwicklung eines neuartigen Systems für die optische Biopsie von Hautkrebs. Der Ansatz nutzt eine Kombination von vier meist, optischen Modalitäten zur Bestimmung der zur Diagnostik relevanten Parameter sowie künstliche Intelligenz für die schnelle Klassifizierung der Hautläsionen. Er trägt somit zur digitalen Transformation im Gesundheitswesen bei und ist auch für die Telemedizin geeignet.Leitung: Prof. Dr. Bernhard RothTeam:Jahr: 2020
-
Non-contact dermatoscope for detection and examination of suspicious skin lesionsThe standard method for the examination of skin lesions is contact dermoscopy. With the contemporary contact-type dermoscopes, lesions have to be scanned manually by imaging each lesion in direct contact with the skin. Although established this procedure has several drawbacks as it is time consuming, has poor reproducibility, and may even be painful for the patient. A non-contact remote dermoscope can overcome these drawbacks and furthermore allow automatized screening protocols. Thus, this project revolves about the development of a non-contact dermoscope for detection and examination of suspicious skin lesions.Leitung: B. Roth, M. Wollweber, U. MorgnerTeam:Jahr: 2017
![]()
![]()
-
Melanomdickenbestimmung mittels Optoakustik und OCTEntwicklung eines Verfahren zur präoperativen Bestimmung der Dicke von Melanom-verdächtigen Hautläsionen.Leitung: B. Roth, M. Wollweber, U. Morgner, M. RahlvesJahr: 2013Förderung: BMBF
![]()
![]()
-
Hautkrebsscreening (HKS)Entwicklung eines digitalen Dermatoskopiegerätes mit erweitertem Diagnoseumfang für das automatisierte Ganzkörper-Hautkrebs-Screening (Melanom-früherkennung)Leitung: M. WollweberJahr: 2012




